腾盛博药发布2023年度全年财务业绩及公司最新进展
 |
将乙肝治愈项目推进至多项后期临床联合研究,2024年和 2025年取得的中期结果将为公司的注册战略提供依据
通过收购BRII-179的全球知识产权并拓展生产布局,以整合研发、生产和商业优势
优化公司资源,3.76亿美元的充足现金将支持公司运营至 2027年
公司将于3 月 25日上午8:30(香港时间)/ 3月24日晚间8:30(美东时间)召开电话会议(中文场)
中国北京和美国北卡罗莱纳州达勒姆市2024年3月22日 /美通社/ -- 腾盛博药生物科技有限公司("腾盛博药"或"公司",股票代码:2137.HK),一家致力于针对患者未被满足的需求以及重大公共卫生性疾病开发创新疗法的跨国企业,今日发布了最新公司进展和截至2023年12月31日的全年业绩报告。
2023年,公司在其重点的乙型肝炎病毒(HBV)项目中取得了重要里程碑,推动了HBV功能性治愈新型联合疗法的开发,同时拓展了产品组合。随着正在进行的多个HBV候选药物临床试验产生形成性数据,以及获得了BRII-179的全球知识产权和生产技术,公司将在2024年启动多项联合疗法的研究。
腾盛博药董事长兼首席执行官洪志博士表示:"2023年对腾盛博药来说是关键的一年,我们从多项2期联合研究中获得了重要洞见。通过过去5年的积极临床研究,我们深入了解了最大限度减少和维持乙肝表面抗原(HBsAg)清除所需的条件。基于BRII-179,我们制定了评估和增强乙肝患者内在免疫力的策略,针对最有可能产生应答的患者进行治疗,同时避免其他患者接受不必要的治疗。这些重要突破为我们的后期临床联合研究提供了依据。"
2023财年及近期公司进展
- 2024年2月,腾盛博药与VBI Vaccines, Inc.("VBI",纳斯达克股票代码:VBIV)达成协议,收购 BRII-179的全球知识产权和生产技术,以扩大其未来的全球生产和供应能力。同时还取消了未来向VBI支付的与BRII-179和PreHevbriTM相关的费用。
- BRII-179于2023年11月获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)颁发的突破性疗法认定(BTD),加快为HBV患者提供创新疗法。
- 腾盛博药于2023年7月获得PreHevbriTM在大中华区和亚太地区(日本除外)的独家开发和商业化权益,并已就PreHevbriTM在中国的注册计划向CDE提交了两项临床前申请(pre-IND)。香港的上市注册申请也已提交。
- 腾盛博药已优化其资源,重点投入其领先的HBV产品组合的临床和商业开发中。公司正积极寻求合作机会,以进一步开发其中枢神经系统(CNS)、人类免疫缺陷病毒(HIV)和多重耐药和广泛耐药(MDR/XDR)领域拥有全球权益的管线。
- 腾盛博药任命Brian A. Johns博士为首席科学官,负责腾盛博药的早期发现项目,并制定公司未来的管线战略。我们的新组织战略由在感染性疾病领域拥有丰富经验的领导者所引领,以确保公司管线目标的达成。
2023财年临床管线亮点和未来里程碑
乙型肝炎病毒(HBV)项目
2023年获得的关键数据证明,我们拥有所有权的治疗性疫苗BRII-179可在慢性乙型肝炎患者引发强效的特异性免疫应答,其与临床疗效的改善密切相关。腾盛博药与其战略合作伙伴将于2024年开展一系列确证性联合研究,旨在建立以BRII-179为核心的未来乙肝治疗方案。为了进一步履行我们在BRII-179上的承诺,腾盛博药与VBI就全球知识产权和生产权益达成交易。我们正与合作伙伴密切合作,以启动后期临床研究,来明确BRII-179和BRII-835(elebsiran)对提高HBV功能性治愈率的贡献。此外,BRII-179有可能识别出能产生良好抗体应答并获得更高功能性治愈机会的慢乙肝患者。
关键数据及开发计划
- BRII-179 相关研究和计划
- 在 2023 年 11 月举行的美国肝病研究协会年会(AASLD)上,腾盛博药展示了两份关于BRII-179的突破性壁报,揭示了HBsAg清除率与乙肝表面抗体反应之间的重要联系。这些数据为进一步提高功能性治愈率和识别最有可能对治愈性疗法产生应答的患者指明了方向。
- BRII-179可诱导功能性免疫应答,提高接受联合聚乙二醇干扰素α(PEG-IFNα)治疗的慢乙肝患者的HBsAg清除率和清除持续时间,进而可能提高慢乙肝患者功能性治愈率。
- 腾盛博药对BRII-179和BRII-179联合BRII-835(elebsiran)开展的1b/2a期研究的转化研究数据表明,BRII-179可能有助于识别出能够产生必要HBV特异性免疫应答的慢乙肝患者,从而在这些被筛选出的患者中实现更高的功能性治愈率,同时避免了其他患者接受不必要的治疗。
- 腾盛博药计划在2024年下半年启动多项联合研究,以验证BRII-179与其他疗法联合使用时提高HBV功能性治愈率的能力。
- 腾盛博药将在2024年3月27日至31日于日本京都举行的第33届亚太肝脏研究学会(APASL)会议上,以突破性口头报告的形式公布其正在进行的BRII-179联合PEG-IFNα治疗慢乙肝患者的 2 期研究中,符合核苷酸逆转录酶抑制剂(NRTI)停药标准的患者数据。
- 在 2023 年 11 月举行的美国肝病研究协会年会(AASLD)上,腾盛博药展示了两份关于BRII-179的突破性壁报,揭示了HBsAg清除率与乙肝表面抗体反应之间的重要联系。这些数据为进一步提高功能性治愈率和识别最有可能对治愈性疗法产生应答的患者指明了方向。
- BRII-835(Elebsiran)& BRII-877(Tobevibart)相关研究和计划
- 已完成在包括中国大陆在内的亚太地区开展的BRII-835(elebsiran)联合PEG-IFNα的2期研究患者入组工作。该研究旨在进一步了解BRII-835(elebsiran)相较单用PEG-IFNα对提高HBV治愈率方面的效果,并探索BRII-179在筛选出合适的患者以获得更佳疗效方面的潜力。该研究的初步顶线结果预计将于2024年第四季度公布。
- 腾盛博药的合作伙伴Vir Biotechnology, Inc.("Vir",纳斯达克股票代码:VIR)在2023年11月的AASLD会议上展示了MARCH研究B部分的新数据。数据显示,在将BRII-877(tobevibart)加入联合或不联合PEG-IFNα的BRII-835(elebsiran)方案中治疗24周后,应答率提高了约三倍: BRII-877(tobevibart)+ BRII-835(elebsiran)+ PEG-IFNα的应答率为15.0%,BRII-877(tobevibart)+ BRII-835(elebsiran)的应答率为14.3%。治疗48周的队列数据将于2024年第四季度公布。
- Vir在2023年11月AASLD会议的突破性报告中,以及在2024年1月第42届摩根大通医疗健康年会上,分享了SOLSTICE研究中一小部分慢性丁型肝炎(CHD)参与者的初步数据。经过12周的BRII-877(tobevibart)和BRII-835(elebsiran)联合治疗后,6名参与者中有5人无法检测到丁型肝炎病毒核糖核酸(HDV RNA),6名参与者中有6人的HDV RNA低于定量下限。其他数据将于2024年第二季度公布,完整的24周治疗数据预计将于2024年第四季度公布。
- BRII-877(tobevibart)的一项1期研究正在中国开展。中国大陆受试者的人体药代动力学(PK)数据将与亚太地区和欧洲的受试者进行比较。
其他临床和临床前开发更新
基于公司所专注的HBV项目战略,腾盛博药正寻求以下项目后续开发的合作机会。
多重耐药和广泛耐药(MDR/XDR)革兰氏阴性菌感染项目
- BRII-693
- 腾盛博药于2023年6月获得了开发和商业化BRII-693的全球独家权益,BRII-693是一种新型多粘菌素,用于治疗严重的革兰氏阴性感染。公司正寻求战略资金合作伙伴,以加快BRII-693的开发,这种新型抗生素旨在帮助应对全球日益严峻的抗菌药耐药威胁。
- 2023年4月,腾盛博药向NMPA提交了BRII-693的pre-IND申请,计划在中国启动1期临床PK桥接研究。公司正计划开展更多PK临床研究,以支持3期临床试验的启动。这些研究对支持全球开发工作至关重要。针对医院获得性细菌性肺炎(HABP)/呼吸机相关细菌性肺炎(VABP)的大型全球3期注册性临床试验预计将于2025年开展。
人类免疫缺陷病毒(HIV)项目
- BRII-753是公司内部研发的新化学实体,目前正处于临床前开发阶段。BRII-753是一种长效皮下注射剂,可每月一次、每季度一次或每年两次给药,可用于治疗HIV的联合疗法和暴露前预防的单药疗法。
- BRII-732已完成1期研究,有潜力开发为HIV患者每周口服一次的长效联合治疗方案的一部分。
非结核分枝杆菌(NTM)肺病项目
- BRII-658(Epetraborole):2024年2月,腾盛博药的合作伙伴AN2 Therapeutics, Inc.(纳斯达克股票代码:ANTX)宣布自愿暂停其epetraborole(BRII-658)治疗难治性复合分枝杆菌(MAC)肺病的2/3 期临床试验患者招募,以待进一步的数据审查。
产后抑郁症(PPD)和重度抑郁症(MDD)项目
- BRII-296:2023年9 月,评估BRII-296的2期研究完成首例患者给药。BRII-296是一种长效注射剂,正在开发用于治疗PPD。公司预计将于2024年第二季度公布2期试验数据。
- BRII-297是一种长效注射剂,正在开发用于治疗焦虑症和抑郁症,该药的1期临床试验已完成患者给药。该研究旨在评估BRII-297在健康志愿者中的安全性、耐受性和药代动力学,预计将于2024年下半年获得数据。
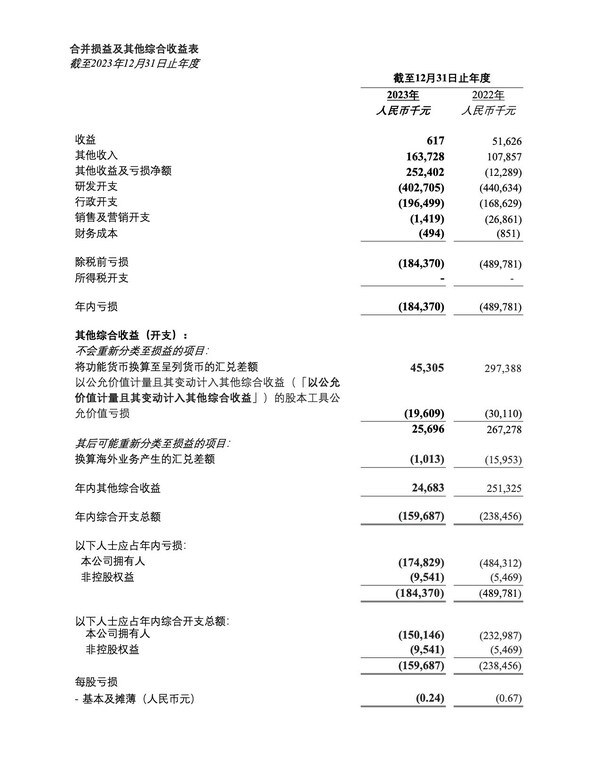
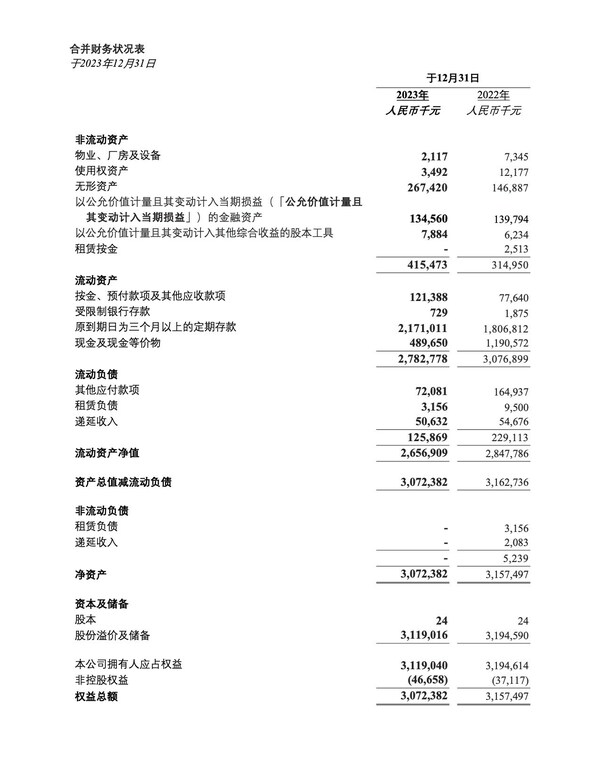
2023年全年财务业绩
- 截至2023年12月31日,银行存款以及现金及现金等价物为人民币26.614亿元,与截至2022 年12月31日的人民币29.993亿元相比,减少人民币3.379亿元或11.3%。该减少主要是由于日常营运及研发活动支出。
- 截至2023年12月31日止年度,其他收入为人民币1.637亿元,与截至2022 年12月31日止年度的人民币1.079亿元相比,增加人民币5,580万元或51.7%。这主要是由于美元及港元定期存款利率上升导致银行利息收入增加人民币7,080万元。该增加部分被确认的中国政府补助收入减少所抵销。
- 截至2023年12月31日止年度,研发开支为人民币4.027亿元,与截至 2022年12月31日止年度的人民币4.406亿元相比,减少人民币3,790万元或8.6%。该减少主要是由于COVID-19项目终止。
- 截至2023年12月31日止年度,行政开支为人民币1.965亿元,与截至 2022年12月31日止年度的人民币1.686亿元相比,增加人民币2,790万元或16.5%。该增加主要归因于雇员成本增加。
- 截至2023年12月31日止年度,综合开支总额为人民币1.597亿元,与截至2022年12月31日止年度的人民币2.385亿元相比,减少人民币7,880万元或33.0%。该减少主要归因于其他收益及亏损增加,部分被由功能货币换算至呈列货币的汇兑差额所产生的收益减少所抵销。
电话会议信息
公司将于2024年3月25日,香港时间上午8:30(美国东部时间3月24日晚间8:30)举行电话会议(中文场)。在参加电话会议之前,参会者须完成会议注册。注册链接请点击这里。
所有参会者须在电话会议之前通过上述链接完成在线注册。此外,此电话会议的回放将在会议后提供,并可通过访问公司网站www.briibio.com的投资者关系版块获取。
***
本新闻稿涉及第三方信息的引用。此类信息不应被视为参考信息纳入本新闻稿中。腾盛博药对此类第三方信息的不负任何责任。
关于腾盛博药
腾盛博药(股票代码:2137.HK)是一家生物技术公司,致力于针对存在巨大未被满足的患者需求、治疗手段有限,以及给患者带来严重社会歧视的重大公共卫生挑战开发创新疗法。公司专注于感染性疾病和中枢神经系统疾病,正在推进一条涵盖多种独特候选药物的产品管线,并通过领先的项目开发针对乙型肝炎病毒(HBV)感染的新型功能性治愈方案,和针对产后抑郁症(PPD)以及重度抑郁症(MDD)的首创治疗方案。在富有远见卓识和经验丰富的领导团队带领下,公司在位于罗利-达勒姆、旧金山湾区、北京和上海的主要生物技术中心开展业务。欲了解更多信息,请访问www.briibio.com。
前瞻性声明
本新闻稿中传达的信息包含某些具有或可能具有前瞻性的陈述。这些陈述通常包含诸如"将"、"期望"、"相信"、"计划"和"预期"等词语以及类似含义的词语。就其性质而言,前瞻性陈述涉及风险和不确定性,因为它们与事件相关并取决于未来将发生的情况。可能存在目前被认为不重要或公司未意识到的其他重大风险。这些前瞻性陈述并非对未来业绩的保证。在这些不确定性的背景下,读者不应依赖这些前瞻性陈述。前瞻性陈述可能更新或根据未来的事件或发展进行相应修改,对此公司不承担任何责任。
媒体问询:
media@briibio.com
投资者问询:
ir@briibio.com